Оценка антигенной активности монокомпонентов вакцины против вирусной диареи, рота-, коронавирусной инфекции, эшерихиоза и протеоза «Энтеровак-5» на лабораторных животных
Цель исследований – изучение антигенной активности монокомпонентов при конструировании инактивированной поливалентной вакцины против вирусной диареи, рота-, коронавирусной инфекции, эшерихиоза и протеоза телят «Энтеровак-5» в зависимости от способа инактивации на лабораторных животных. Установлено, что, наиболее оптимальным средствами инактивации вирусов и бактерий являются теотропин и формалин, т.е. введение животным инактивированных данными препаратами вирусов и бактерий позволяет получить достаточно высокий титр противовирусных и антибактериальных антител – титр противовирусных антител достигает 1:64, антибактериальных – 1:128-1:256.
Проблема смешанных инфекций желудочно-кишечного тракта приобретает в последнее время чрезвычайную актуальность в связи с возрастающей частотой выявления этой патологии. Особенное значение имеет эта проблема при заболеваниях желудочно-кишечного тракта новорожденных телят.
Выраженная полиэтиологичность, одновременная широкая циркуляция возбудителей вирусной и бактериальной природы во внешней среде, возможность раннего инфицирования, а также незрелость иммунной системы новорожденного создают весьма благоприятные условия для формирования смешанных инфекций.
Среди основных инфекционных агентов, вызывающих патологию желудочно-кишечного тракта у телят, основную роль играют: вирус диареи, рота-, коронавирусы, патогенные штаммы E.coli, протей и др., а также их ассоциации. Синергическое взаимодействие вирусов, бактерий и простейших на фоне стресс-факторов и пониженной резистентности организма телят, приводит к развитию тяжело протекающих гастроэнтеритов, сопровождающихся значительным отходом животных. Воздействие нескольких инфекционных агентов на организм животного является чрезвычайно сложным новым процессом, который не может быть выражен простым суммированием признаков, характерных для каждой из составляющих его моноинфекций.
Существующие в настоящее время средства специфической профилактики базируются, в основном, на применении моновакцин для иммунизации глубокоcтельных коров с целью создания у новорожденных телят колострального иммунитета. Кроме того, применение моновакцин не позволяет формировать иммунитет против нескольких возбудителей желудочно-кишечных заболеваний.
Со смешанными инфекциями, как утверждает Mayr (1984), нельзя бороться только классическими методами, так как трудно определить ведущую роль того или иного инфекционного агента, поэтому для профилактики таких болезней должны быть разработаны комбинированные вакцины, с функционально синергическим действием как вирусных, так и бактериальных компонентов.
Цель настоящей работы – изучение антигенной активности монокомпонентов при конструировании инактивированной поливалентной вакцины против вирусной диареи, рота-, коронавирусной инфекции, эшерихиоза и протеоза телят «Энтеровак-5» в зависимости от способа инактивации на лабораторных животных.
Исследования проводились в условиях научной лаборатории кафедры эпизоотологии и инфекционных болезней УО «Витебская ордена «Знак Почета» государственная академия ветеринарной медицины» и клиники кафедры.
Объектом для исследования являлись лабораторные животные (мыши), их сыворотка крови.
Вирусы диареи и коронавирусы накапливали на перевиваемой культуре клеток почки теленка МДБК, а ротавирусы – на перевиваемой культуре клеток почки поросенка СПЭВ по общепринятой методике, эшерихии и протей – на мясо-пептонном агаре (МПА).
Титрацию вирусов проводили микрометодом на чувствительной культуре клеток с использованием метода Рида и Менча, а концентрацию бактерий – путем сравнения со стандартом мутности.
Для изучения антигенной активности аттенуированных штаммов – компонентов инактивированной поливалентной вакцины против вирусной диареи, рота-, коронавирусной инфекции, эшерихиоза и протеоза телят «Энтеровак-5» исследования проведены на лабораторных животных (белых мышах). Для оценки антигенной активности вирусных компонентов вакцины «Энтеровак-5» использованы 7 групп белых мышей по 5 голов в группе. Мышам опытной группы № 1 вводили 0,2 мл вируса диареи, инактивированного формалином; опытной группы № 2 – 0,2 мл вируса диареи, инактивированного теотропином м, опытной группы № 3 – 0,2 мл ротавируса, инактивированного формалином; опытной группы № 4 – 0,2 мл ротавируса, инактивированного теотропином, опытной группы № 5 – коронавируса, инактивированного формалином; опытной группы № 6 – коронавируса, инактивированного теотропином. Группа №7 – мышам вводили 0,2 мл изотонического раствора натрия хлорида. Вирусные антигены вводились двукратно с интервалом в 14 дней.
Для оценки антигенной активности бактериальных компонентов вакцины «Энтеровак-5» использованы 11 групп белых мышей. Мышам опытной группы № 1 вводили 0,2 мл суспензии E. coli – К88 ВГНКИ, инактивированной формалином; опытной группы № 2 – 0,2 мл суспензии E. coli – К88 ВГНКИ, инактивированной теотропином, опытной группы № 3 – 0,2 мл суспензии E. coli – K99 ВГНКИ, инактивированной формалином; опытной группы № 4 – 0,2 мл суспензии E. coli – K99 ВГНКИ, инактивированной теотропином, опытной группы № 5 – суспензии E. coli – 987Р ВГНКИ инактивированной формалином; опытной группы № 6 – суспензии E. coli – 987Р ВГНКИ, инактивированнй теотропином, опытной группы № 7 – суспензии E. coli – F41, А20 ВГНКИ инактивированной формалином опытной группы № 8 – суспензии E. coli – F41, А20 ВГНКИ, инактивированнй теотропином, опытной группы № 9 – суспензии E. coli – Pr.miracilis, инактивированной формалином; опытной группы № 10 – суспензии Pr.miracilis, инактивированнй теотропином, группа № 11 – мышам вводили 0,2 мл изотонического раствора натрия хлорида. Бактериальные антигены вводились двукратно с интервалом в 14 дней.
У опытных животных кровь брали до введения вирусов и через 21 день после второго введения антигенов. В сыворотке крови определяли титр противовирусных антител в РНГА с использованием эритроцитарных диагностикумов с антигенами вирусов диареи, рота- и коронавирусов. Эритроцитарные диагностикумы с антигенами вышеуказанных вирусов для постановки реакции непрямой гемагглютинации представляет собой стабилизированные 0,3% глютаровым альдегидом эритроциты барана, сенсибилизированные антигенами вирусов с помощью конъюгирующих веществ – хлорида хрома с трипановым синим. Диагностикумы хранили в консерванте, представляющем собой фенолизированный изотонический раствор натрия хлорида с нормальной кроличьей сыворотки в течение 1 года с даты изготовления. Постановка и учет РНГА проводилась по общепринятой методике. Антибактеральные антитела изучали в РА с соответствующими инактивированными штаммами микроорганизмов. Статистическую обработку полученных результатов проводили с использованием компьютерной программы Bio-Stat 2070.
В таблице 1 приведены результаты изучения антигенной активности аттенуированных штаммов вирусов ВД, рота- и коронавирусов на мышах.
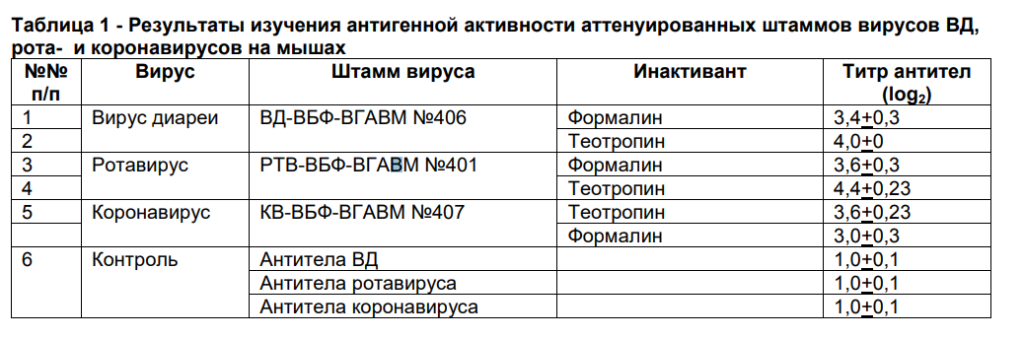
Данные таблицы показывают, что введение мышам вируса в тест—дозе вызывает выработку противовирусных антител от 3,0 до 4,0 log2 .
В табл. 2 представлены результаты изучения титров антибактериальных антител у мышей при изучении антигенной активности инактивированных штаммов бактерий – E. Coli и Pr.miracilis
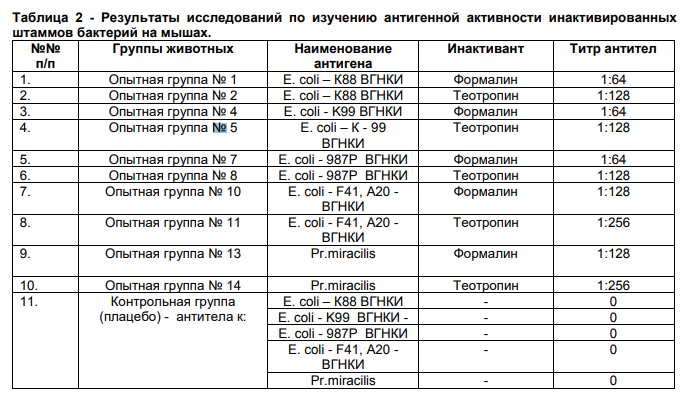
В результате постановки РА титр антител к эшерихиям, инактивированным формалином был 1:64-1:128, теотропином – 1:128-1:256, титр антител в РА к Pr.miracilis, инактивированному формалином- 1:128, теотропином – 1:256.
Таким образом, наиболее оптимальным средством инактивации вирусов и бактерий является теотропин и формалин, т.е. введение животным инактивированных данными препаратами вирусов и бактерий позволяет получить достаточно высокий титр противовирусных и антибактериальных антител – титр противовирусных антител достигает 1:64, антибактериальных – 1:128-1:256.













