Активность, видовая специфичность и реактогенность туберкулина очищенного в сравнении с ппд туберкулинами разных производителей у КРС
На современном этапе туберкулёз считается одной из значимых проблем инфекционной патологии животных и человека.
Туберкулез представляет собой хроническую инфекционную болезнь человека и животных с образованием в органах и тканях специфических гранулем (туберкулов, бугорков).
Наибольшую экономическую и социальную опасность представляет туберкулез крупного рогатого скота. У больных животных снижаются молочная продуктивность (на 11,6-30%), привесы, живая масса (на 7,1-11,1%), выход телят (на 6,5%). Потери также связаны с затратами на диагностику, убой животных, обезвреживание молока, санацию помещений и территории, а также с ограничениями продажи и экспорта животных.
Основным методом прижизненной диагностики туберкулёза крупного рогатого скота является аллергическая проба с туберкулином. Туберкулинодиагностика имела серьёзные успехи ещё на рубеже 19 и 20 веков. Так, к концу 19 века назрела необходимость принятия радикальных противотуберкулезных мер. В 1899 г. на VII Ветеринарном конгрессе разработаны рекомендации и поставлена одна из главных задач ветеринарной медицины – разрыв эпизоотической цепи за счет выявления и убоя больных животных, контроля туш, термической инактивации молока и мяса, охраны ферм и уничтожения резервуаров инфекции.
Нараставшая пандемия, заставила проводить борьбу с туберкулезом крупного рогатого скота в национальных масштабах. В 1909 году рекомендован переход от добровольности мероприятий к обязательной государственной борьбе с болезнью в различных странах.
На начальном этапе речь шла о выявлении и убое коров с клиническими формами. Позднее были разработаны более чувствительные методы диагностики. Bang (1898) предложил внутрикожное введение туберкулина, а Остертаг (1912) – клинический осмотр и бактериологическое исследование.
В Дании в 1936 году 40,3% коров были поражены туберкулезом. 19 лет туберкулинодиагностики и убоя реагировавших коров уменьшили число зараженных животных до 0,07%. Использование туберкулинизации позволило оздоровить большинство стран Западной Европы. В 2005 г. статус стран, официально свободных от туберкулеза крупного рогатого скота, имели Австрия, Бельгия, Чехия, Дания, Финляндия, Франция, Германия, Люксембург, Нидерланды, Словакия и Швеция.
В СССР был разработан ускоренный метод оздоровления стад, который использовался и в Республике Беларусь. Метод предусматривал проведение туберкулинизаций через 30-45 дней до получения отрицательного результата с последующей перепроверкой через 2-2,5 месяца. Если по алго ритмам исследований, заложенным в национальных программах западных стран, эффект достигался через 7-20 лет, то по ускоренному методу – через 1-2 года.
Несмотря на успехи в оздоровлении целых регионов и стран, угроза активизации туберкулезной инфекции в них сохраняется. Это вызывает необходимость постоянного контроля ситуации путем проведения туберкулинизации. Так, начиная с 1959 г. в Великобритании число реагирующих на туберкулин коров неуклонно снижалось, но с 1992 года начался рост, достигший в 2004 г. показателя 50 реагирующих коров на 10000 исследованных . В 2011 г. реагирующие на туберкулин коровы были обнаружены в 9,17% стад Северной Ирландии, в 6,87% стад Великобритании, в 5,72% Ирландии, 1,11%, Испании, 0,74% Греции, 0,04% Польши и 0,01% Германии. В Новой Зеландии, несмотря на низкий уровень инцидентности, в 2011 г. было 80 инфицированных стад.
В настоящее время туберкулины это сложные смеси водорастворимых антигенов микобактерий туберкулеза, выращенных на жидких питательных средах, инактивированных высокой температурой. Существует несколько разновидностей туберкулинов: альттуберкулины, HCSM (безальбумозные) и PPD (purified protein derivative, ППД) туберкулины, которые получают по разным технологиям.
Основные требования к производству туберкулинов определены ВОЗ (Всемирная организация здравоохранения) и МЭБ (Международное эпизоотическое бюро). Они касаются терминологии, штаммовпродуцентов, безопасности производства и конечного продукта, а также обеспечения его соответствия международному эталону.
Основными показателями качества туберкулина очищенного считаются активность, видовая специфичность, а также реактогенность, оценка которых в выпускаемых образцах туберкулинов является актуальной задачей.
Цель исследований – изучение активности, видовой специфичности и реактогенности туберкулина очищенного в сравнении с ППД туберкулинами разных производителей у крупного рогатого скота, инфицированного микобактериями разных видов.
Работа выполнена на кафедре микробиологии и вирусологии УО ВГАВМ, ОАО «БелВитунифарм», в отделе зоонозов и разработки диагностических препаратов РУП «Институт экспериментальной ветеринарии им. С.Н. Вышелесского», хозяйствах РБ.
В работе использовали штаммы Mycobacterium bovis 8, Mycobacterium bovis Vallee (Москва, ВГНКИ, КМИЭВ №9, №10), Mycobacterium bovis BCG-1 (Институт эпидемиологии и микробиологии им. Н.Ф. Гамалеи, Москва), Mycobacterium avium 1603, Mycobacterium scrofulaceum 526, Mycobacterium fortuitum 342, Mycobacterium phlei 1889 (Москва, ЦНИИТ (Центральный научно-исследовательский институт туберкулёза)), Mycobacterium terrae 17522 ATc C.
Штаммы поддерживали на среде Гельберга, пересевая через 6 месяцев. Морфологические, культуральные свойства M. bovis 8 (КМИЭВ №9), M. bovis Vallee (КМИЭВ №10) изучали путем посева суспензий на среду Гельберга и МПА с инкубацией при 20°, 37° и 45°С. Из культур готовили препараты-мазки, которые окрашивали по Цилю-Нильсену.
В эксперименте на крупном рогатом скоте, зараженном M. bovis, а также смесью штаммов M. avium 1603, M. terrae 17522, M. fortuitum 342 сравнили контрольные (№№20, 37, 50) и производственные серии туберкулина очищенного (№№ 24, 29, 33) в стандартном растворе и в разведении 1:5:
- с ППД туберкулином из штамма AN 5 (P-481/98) Biovet Польша, который вводили в цельном виде в дозе 3250 IU/0,2 мл (7500 CTU, 0,1 мг туберкулопротеина) и в разведении 1:5 в дозе 650 IU/0,2 мл (1500 CTU, 0,02 мг туберкулопротеина);
- с PPD tuberculina mamifera AN5, 3412487 H, SENASA 121 12/06 ELAB, Аргентина, который вводили в дозах 0,1 mg и 0,02 mg (в 0,2 мл);
- со стандартным раствором ППД туберкулина серии 11, ФГУП «Курская биофабрика».
Инъекции делали в подготовленные симметричные участки кожи шеи, реакции учитывали через 72 ч после введения аллергенов путем измерения утолщений кожных скпадок.
В таблице 68 приведены результаты сравнения активности и специфичности контрольной серии ТО №37 и ППД туберкулина AN5 Biovet Pulawy в опыте на крупном рогатом скоте. Установлено, что у животных, инфицированных M. bovis, на диагностическую дозу ТО 37 среднее утолщение кожной скпадки составило 4,0 мм, на ППД туберкулин AN5 Biovet – 3,83 мм. Из 6 случаев интенсивность реакции на отечественный препарат была выше в 1, а в 5 случаях совпадала с аналогом. Фактически стандартный раствор ТО серии 37 выявил всех трех инфицированных животных, а ППД туберкулин AN 5 Biovet Pulawy только 2.

При сравнении интенсивности реакций в зависимости от логарифма дозы в единицах активности CTU (рисунок 39) и логарифма концентрации белка (рисунок 40) линии активности практически совпадали, что указывает на примерно равную активность препаратов у животных, зараженных M. bovis.

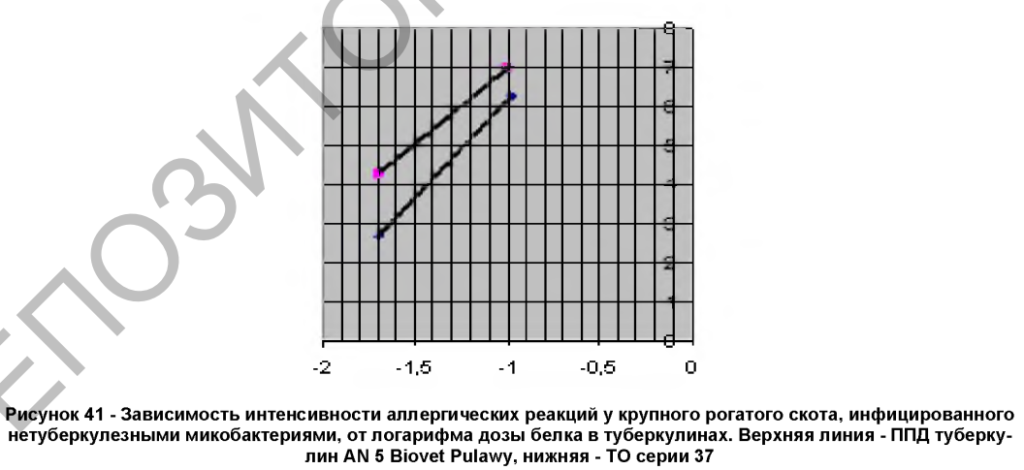
Стандартные растворы обоих туберкулинов выявляли одинаковое количество животных, инфицированных НТМБ. Однако интенсивность реакций на ППД туберкулин Biovet Pulawy была заметно выше (таблица 1). На рисунке 3 представлена зависимость интенсивности аллергических реакций у крупного рогатого скота, инфицированного НТМБ, от дозы белка в туберкулинах. Как видно, расстояние между линиями активности в среднем составило 0,24 lg, antilog – 0,24 = 0,58. Это указывает на то, что видовая специфичность диагностической дозы ТО (10000 CTU) у животных, инфицированных НТМБ, существенно выше и соответствует дозе ППД туберкулина Biovet Pulawy – 4350 CTU, или на то, что препарат типа ТО на 42% специфичнее ППД. В целом результаты сопоставления показали, что ТО серии 37 выявлял больше животных, инфицированных M. bovis, при этом его видовая специфичность была выше, чем у ППД туберкулина AN 5 Biovet Pulawy.
При сравнении ТО серии 20 с ППД AN5 (Аргентина) на животных, сенсибилизированных M. bovis, установлено (таблица 69), что на диагностические дозы (I доза) реакции отмечены у всех сенсибилизированных животных. В 3 случаях из 5 они были интенсивнее на ТО ОАО «БелВитунифарм». На 5-кратно разведенный PPD AN5 (II доза) реагировало 3 из 5 животных, на соответствующее разведение ТО серии 20 реагировало 4 из 5 животных. В целом из 10 случаев реакций на оба разведения в 5 случаях они были более интенсивные на отечественный препарат, в одном случае – равные, что свидетельствует о равной активности сравниваемых препаратов и соответствии белорусского туберкулина зарубежным образцам.
При сравнении активности и специфичности ТО серии 37 с PPD AN5 (Аргентина) установлено (таблица 3), что все животные, зараженные или сенсибилизированные M. bovis, реагировали на I дозу сравниваемых препаратов. На II дозу этот показатель составил 5 и 3. Всего из 12 случаев в 6 более интенсивная реакция была на PPD AN5. Следовательно, активность сравниваемых препаратов достоверно не отличалась.
При оценке видовой специфичности на животных, сенсибилизированных смесью M. avium 1603, M. terrae 17522, M. fortuitum 342 (таблица 70), на диагностическую дозу PPD AN5 реагировало 3 из 3, а на ТО серии 37 – 2 из 3 животных. На разведенный PPD AN5 реакция отмечалась у 2 из 3 животных. Реагирующих на пятикратно уменьшенную дозу ТО не было. Эти результаты подтверждают большую видовую специфичность ТО, примерно на 33%.
При сравнении активности ТО производственных серий 24 и 33 с ППД Курской биофабрики и PPD AN5 (Аргентина) установлено, что производственные серии ТО и PPD AN5 выявили всех инфицированных животных с сопоставимыми по интенсивности кожными реакциями. ППД Курской биофабрики выявил только 4 животных из 5.

Сопоставимые реакции были и на обе производственные серии 33 и 24 ТО, что указывало на их корректную стандартизацию. В опыте по сравнению ТО производственной серии 29 с PPD AN5 оба туберкулина выявляли животных, зараженных возбудителем туберкулеза (таблица 5). Но если на PPD AN5 реагировало 1 животное из 2, инфицированных НТМБ, то на ТО серии 29 эти животные не реагировали, что еще раз подтверждает большую специфичность отечественного препарата, в данном случае на 50%.

Обращает внимание и тот факт, что реакции на ТО всех исследованных серий – 20, 24, 33 и 37 (таблица 70,71,72,73) были более интенсивными в случаях заражения крупного рогатого скота живой культурой M. bovis, чем инактивированным штаммом M. bovis Vallee. Это указывает на то, что технология получения ТО дает меньшую степень денатурации туберкулино-активных компонентов, чем технология получения препаратов типа ППД.

При сравнении активности ТО серии 50 с ППД установлено, что реакции на введение обоих препаратов, животным, зараженным M. bovis, были равноценными (таблица 7, рисунок 4). На рисунке 5 по данным таблицы 7 представлены результаты сравнения видовой специфичности ТО серии 50 с ППД туберкулином серии 11 (верхняя линия) у крупного рогатого скота группы, сенсибилизированной M. avium 1603, M. terrae 17522 ATCC, M. fortuitum 342. Как видно, среднее расстояние по оси абсцисс между линиями активности составляет 0,5 log, что дает коэффициент различия 3,16 (antilog 0,5 = 3,16). Таким образом, видовая специфичность ТО в 3,16 раза выше, чем ППД туберкулина Курской биофабрики. Это коррелирует с оценкой специфичности по критерию положительных реакций: на ППД туберкулин в диагностической дозе реагировало с утолщением кожной скпадки на 3 мми более из 3 животных, сенсибилизированных НТМБ – 2, а на ТО – 0 (таблица 7).


У животных, зараженных возбудителем туберкулеза, стандартный раствор туберкулина очищенного имеет одинаковую или несколько большую активность (на 13,3%), чем стандартные растворы ППД AN5 Biovet Польша, PPD AN5 Аргентина и ППД ФГУП «Курская биофабрика». У животных, зараженных нетуберкулезными микобактериями, реакции на туберкулин очищенный бывают на 33-42% реже, чем на ППДтуберкулины. На несенсибилизированных животных производственные серии туберкулина очищенного для млекопитающих (№№ 24, 29, 33) производства ОАО “БелВитунифарм” реактогенностью не обладали.













